Konsep Dasar Stoikiometri Dalam Ilmu Kimia – Stoikiometri menjadi salah satu pembahasan di bidang Kimia dan dijadikan materi dasar bagi anak-anak yang telah menginjak kelas 10. Materi stoikiometri menjadi materi wajib yang perlu dipahami untuk mempelajari Kimia karena merupakan dasar dari beberapa macam sub-sub bagiannya.
Pembahasan stoikiometri dalam dunia kimia berhubungan dengan penghitungan relasi kuantitatif rumus kimia dan persamaan kimia. Ilmu stoikiometri digunakan untuk mempelajari kuantitas produk dan reaktan dalam reaksi kimia. Konsep stoikiometri berasal dari hukum-hukum dasar di Kimia yang tercipta oleh pemikiran beberapa ilmuwan. Misalnya, hukum kekekalan massa, hukum perbandingan tetap, hukum perbandingan berganda, hukum Boyle, hukum Gay Lussac, dan Hipotesis Avogadro.
Selain berdasarkan hukum-hukum kimia, pemahaman mengenai stoikiometri harus ditelaah berdasarkan konsep dasarnya. Pada kesempatan kali ini kalian akan mempelajari mengenai konsep-konsep dasar dari stoikiometri. Berikut pembahasannya.
Baca Juga: Satuan Jumlah Zat dan Alat Ukur
Baca Juga: Massa Jenis Baja dan Material Lainnya
Baca Juga: Tata Nama Alkohol IUPAC dan Trivial
Konsep Kimia Mengenai Stoikiometri
Stoikiometri merupakan bahasa serapan dari bahasa Yunani yaitu stoicheion yang memiliki makna unsur dan metrcin adalah mengukur. Stoikiometri menjadi ilmu yang mempelajari kuantitas produk dan reaktan dalam reaksi kimia. Dengan kata lain, stoikiometri adalah perhitungan kimia yang menyangkut hubungan kuantitatif zat yang terlibat dalam reaksi. Reaksi dikatakan termasuk reaksi stoikiometri apabila reaktan dalam reaksi habis seluruhnya.
Dalam mempelajari mengenai stoikiometri, perlu dipahami konsep-konsep dasarnya yang diterangkan sebagai berikut.
1. Massa Atom Relatif (Ar)
Massa atom relatif dapat dikatakan sebagai sebuah perbandingan massa suatu atom dengan 1/12 kali massa suatu atom isotop karbon-12 atau C-12. Isotop C-12 ini digunakan sebagai standar karena mempunyai kestabilan inti yang inert dibandingkan dengan atom lainnya.
2. Massa Molekul Relatif (Mr)
Berbeda dengan atom relatif, massa molekul relatif memiliki fungsi dalam mencari perbandingan massa satu molekul senyawa dengan 1/12 kali massa satu atom isotop karbon-12 atau C-12. Pembahasan mengenai molekul menjadi gabungan dari atom-atom suatu unsur. Jadi, Mr merupakan jumlah Ar atom-atom penyusunnya atau dapat dirumuskan dengan Mr = ΣAr.
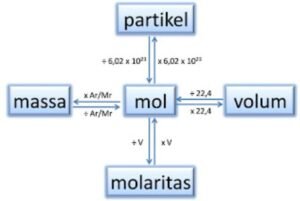
3. Konsep Mol
Dalam konsep mol, satu mol suatu zat dinyatakan sebagai banyaknya zat tersebut yang mengandung 6,02 x 1023 buah partikel. Pada konsep hubungan mol dan jumlah partikel tersebut ditetapkan sesuai hipotesis Avogadro. Selain itu, massa satu mol suatu zat tersebut sama dengan Ar atau Mr yang dinyatakan dalam gram. Contohnya, Ar C = 12 sma maka massa molar karbon = 12 gram/mol.
Baca Juga: Sifat Besi Secara Kimia dan Secara Fisika
Baca Juga: Cara Menghitung Kalori Makanan Untuk Diet Sehat








